
50 mL νερού και 50 mL οινοπνεύματος δίνουν 100 mL διαλύματος, ή όχι;
Όλοι γνωρίζουμε ότι κατά την ανάμιξη ή διάλυση δύο η περισσότερων ουσιών οι μάζες τους αθροίζονται. Έτσι, αν αναμίξουμε 50 g μέλι και 50 g νερό θα προκύψει νερόμελο (διάλυμα) με μάζα 100 g.
Ισχύει το ίδιο όμως με την ανάμιξη ορισμένων όγκων ουσιών; Όχι πάντα!
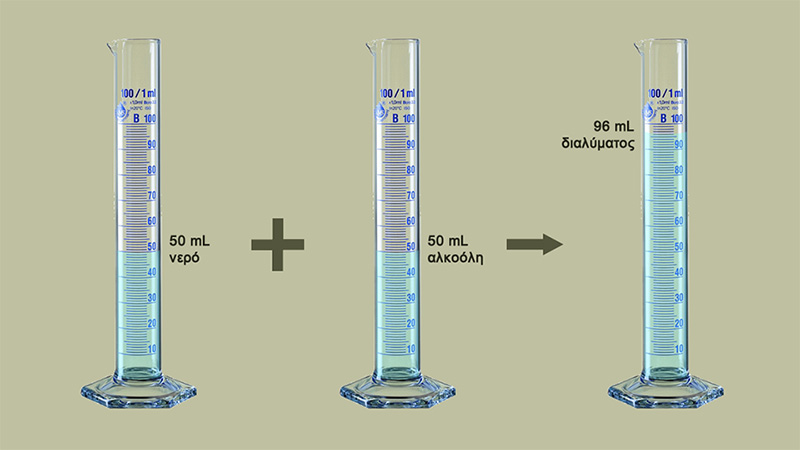
Χαρακτηριστικό παράδειγμα αποτελεί η ανάμιξη νερού και αλκοόλης (οινοπνεύματος). Εύκολα μπορεί να διαπιστώσει κανείς ότι από την ανάμιξη 50 mL νερού και 50 mL αλκοόλης προκύπτει διάλυμα με όγκο 96 mL και όχι 100 mL! Πρόκειται δηλαδή για μια συστολή του συνολικού όγκου του διαλύματος. Γιατί άραγε συμβαίνει αυτό;
Το υγρό νερό έχει μια σχετικά χαλαρή δομή με μεγάλες αποστάσεις μεταξύ των σωματιδίων, με αποτέλεσμα τη δημιουργία μεγάλου κενών χώρων. Κατά την ανάμιξη του νερού με αλκοόλη η χαλαρή αυτή δομή διαταράσσεται και σωματίδια αλκοόλης παρεμβάλλονται στους κενούς χώρους, οποίοι γίνονται λιγότεροι και έτσι ο όγκος μειώνεται (συστέλλεται).
Σημειώνεται ότι το ποσοστό συστολής (4% στο παραπάνω παράδειγμα) δεν είναι σταθερό, αλλά εξαρτάται από τη σύσταση του διαλύματος, δηλαδή την αναλογία νερού και οινοπνεύματος.
Η συστολή αυτή απαντάται σε υδατικά διαλύματα πολλών ουσιών. Για αυτό κατά την παρασκευή ενός διαλύματος x % v/v σε x μονάδες όγκου της προς διάλυση ουσίας προσθέτουμε νερό έως ότου ο όγκος να γίνει 100 μονάδες. Δεν πρέπει ποτέ να αναμιγνύουμε απλώς x μονάδες όγκου της προς διάλυση ουσίας και 100-x μονάδες όγκου νερού, γιατί δεν είμαστε σίγουροι ότι ο τελικός όγκος θα είναι x + (100 - x) = 100 μονάδες όγκου ή μικρότερος!


