
Η αγωγιμότητα των διαλυμάτων των οξέων
Ηλεκτρολύτες ονομάζονται οι χημικές ενώσεις που τα υδατικά τους διαλύματα είναι καλοί αγωγοί του ηλεκτρισμού. Η πειραματική επιβεβαίωση του ηλεκτρολυτικού ρόλου των οξέων γίνεται με την παρακάτω διάταξη δηλαδή με ένα ηλεκτρικό κύκλωμα, η οποία αποτελείται από δύο ηλεκτρόδια γραφίτη (μύτες από μηχανικό μολύβι), ένα καλώδιο, μια μπαταρία, ένα λαμπάκι και ένα ποτήρι ζέσεως.
Όταν μέσα στο ποτήρι ζέσεως στο οποίο είναι βυθισμένα τα ηλεκτρόδια, υπάρχει απεσταγμένο νερό (το νερό αυτό δεν περιέχει καθόλου ιόντα), το λαμπάκι στο κύκλωμα παραμένει σβηστό. Αυτό γίνεται επειδή το νερό είναι κακός αγωγός του ρεύματος και δεν αφήνει να περάσει το ηλεκτρικό ρεύμα μέσα από τη μάζα του, με αποτέλεσμα το κύκλωμα να μένει ανοιχτό.
Όταν μέσα στο νερό προστεθούν μερικές σταγόνες οξέος όπως το υδροχλωρικό οξύ (HCl), οπότε στο ποτήρι ζέσεως θα υπάρχει πλέον αραιό διάλυμα υδροχλωρικού οξέος, το λαμπάκι του κυκλώματος θα ανάψει. Αυτό σημαίνει ότι το κύκλωμα κλείνει αφού το ηλεκτρικό ρεύμα διαρρέει το υδατικό διάλυμα του οξέος.
Τα υδατικά διαλύματα των οξέων είναι καλοί αγωγοί του ηλεκτρικού ρεύματος και συνεπώς τα οξέα είναι ηλεκτρολύτες.
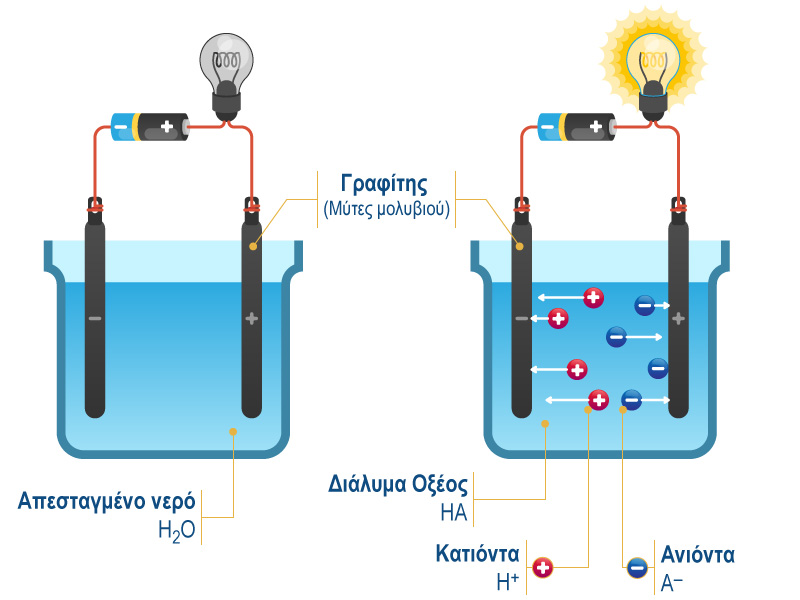
Πιο συγκεκριμένα τα οξέα κατά τη διάλυση τους στο νερό ιοντίζονται, δίνουν, δηλαδή, κατιόντα υδρογόνου (Η+) και αρνητικά ιόντα αμέταλλων ή πολυατομικά ανιόντα. Τα ιόντα αυτά είναι οι φορείς του ηλεκτρικού ρεύματος μέσα στο διάλυμα του οξέος.
HCl(aq) → H+(aq) + Cl-(aq)










